
在生物医药科学的深远探索中,蛋白质结构的精密预测与生物分子间相互作用的透彻理解,构成了核心挑战。5月初,《自然》杂志发表的《Accurate structure prediction of biomolecular interactions with AlphaFold3》一文,激起了广泛讨论。此文中阐述的AlphaFold3模型,采用了一种创新的扩散架构,能够联合预测包括蛋白质、核酸、小分子、离子和修饰残基在内的复合物结构。新的AlphaFold模型在多个方面显示出比以前的特有工具更高的准确性,尤其是在蛋白质-配体相互作用、蛋白质-核酸相互作用及抗体-抗原结构预测的精度上,实现了质的飞跃。踏入AlphaFold3的深度探讨之前,有必要回顾蛋白质折叠的基本原理及其科研价值。蛋白质作为生命的基本构件,氨基酸链通过错综复杂的三维折叠,形成千变万化的功能结构。蛋白质的结构直接决定其功能。比如一把钥匙只能开一把锁,蛋白质也必须有正确的形状才能与特定分子结合。折叠错误可能导致蛋白质失效,引发疾病。因此,准确预测蛋白质结构,根据它的结构设计出有效的药物分子,不仅是理解生命运作机制的关键,也是生物制药与蛋白质工程领域的迫切需求,对推动科研发展具有举足轻重的意义。图片来源:https://www.sohu.com/a/511904965_120195181在此背景下,AlphaFold3的面世,构建于AlphaFold2的坚实基础上,后者已经从本质上解决了从氨基酸序列到蛋白质三维结构预测的难题。AlphaFold3则进一步拓展了预测边界,涵盖了几乎全部生物分子类型及其相互作用的模型化,成为首个能以顶尖水平预测广泛分子间相互作用的系统。AlphaFold3一大亮点就是引入了扩散模型,该模型也被用于OpenAI的Sora、DELL3这样的通用图像大模型。尤为重要的是,AlphaFold3不仅预测结构,还提供预测的置信度评估,为科研人员筛选高可信度预测结果以进行后续实验提供了依据,极大地提升了研究效率。尽管AlphaFold3在预测精度与应用范围上取得了革命性进展,但其运行所需的庞大计算资源与存储空间成为了实际应用中的考量因素,特别是对资源有限的研究机构而言。此外,面对含有大量可变结构域或高度柔性的蛋白质,预测的准确性仍面临挑战。RNA和DNA结构的预测虽有进步,但与蛋白质预测相比,其预测可信度依然较低。AlphaFold3聚焦于静态结构预测,而对于而蛋白质的动态行为捕捉和功能实现涉及复杂的分子间相互作用和构象变化,仍是当前模型面临的难题。对于罕见或未被充分研究的蛋白质,数据稀缺限制了预测的可靠性。蛋白质功能的全貌,还需考虑细胞环境、翻译后修饰等因素,都是需要AI模型进一步探索。最后,尽管AlphaFold3成果显著,实验验证作为理论预测的最终检验,其必要性不可替代。总而言之,AlphaFold3在蛋白质结构预测上的成就,无疑是AI技术应用于生物信息科学领域的一项重要里程碑,但同时也揭示了未来研究的方向与挑战。它不仅是科技进步的象征,更是对未知世界持续探索精神的体现。随着技术的迭代与科学边界的拓宽,我们期待AlphaFold3及其后续发展能引领生物医药研究进入一个更加高效、精准的新时代。目前AlphaFold3没有免费开放,据了解NPAI天然产物AI研发平台的的分子对接应用了AlphaFold2的算法,可体验。
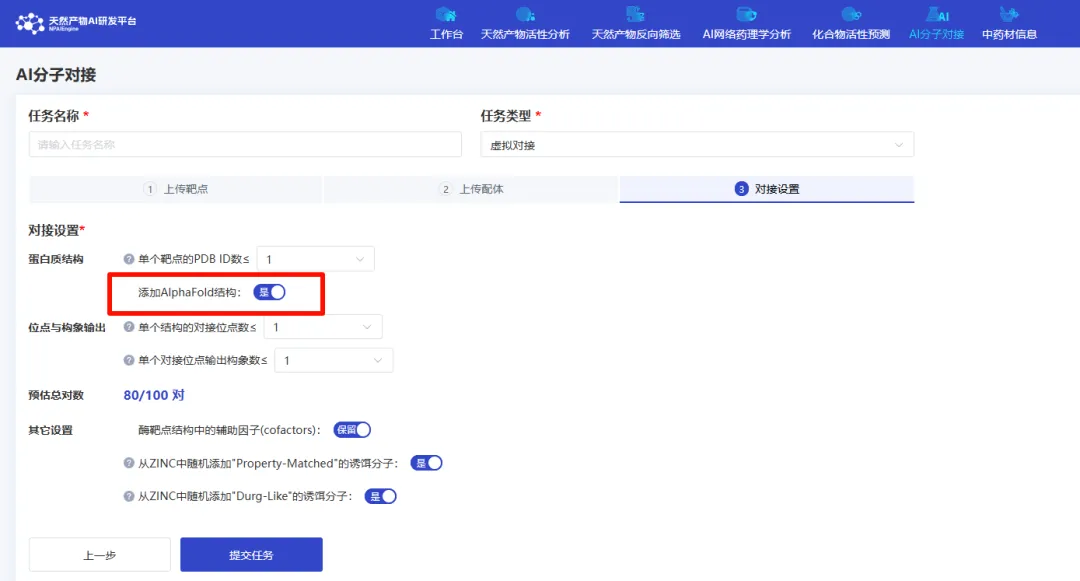
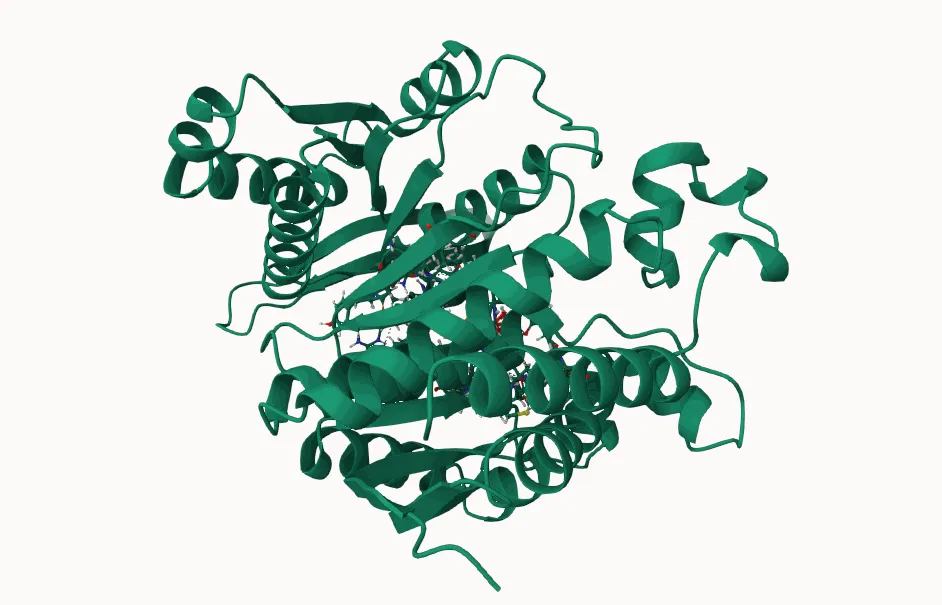
图片来源:NPAIEngine天然产物AI研发平台-分子对接

1.Abramson,J.,Adler,J.,Dunger,J.et al.Accurate structure prediction of biomolecular interactions with AlphaFold 3.Nature(2024).https://doi.org/10.1038/s41586-024-07487-w2.Jumper,J.,Evans,R.,Pritzel,A.et al.Highly accurate protein structure prediction with AlphaFold.Nature 596,583-589(2021).https://doi.org/10.1038/s41586-021-03819-23.https://deepmind.google/discover/blog/alphafold-a-solution-to-a-50-year-old-grand-challenge-in-biology/4.https://golgi.sandbox.google.com/about声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。
图片来源:AlphaFold Server官网在生物医药科学的深远探索中,蛋白质结构的精密预测与生物分子间相互作用的透彻理解,构成了核心挑战。5月初,《自然》杂志发表的《Accurate structure prediction of biomolecular interactions with AlphaFold3》一文,激起了广泛讨论。此文中阐述的AlphaFold3模型,采用了一种创新的扩散架构,能够联合预测包括蛋白质、核酸、小分子、离子和修饰残基在内的复合物结构。新的AlphaFold模型在多个方面显示出比以前的特有工具更高的准确性,尤其是在蛋白质-配体相互作用、蛋白质-核酸相互作用及抗体-抗原结构预测的精度上,实现了质的飞跃。01蛋白质折叠的核心意义与科学追求踏入AlphaFold3的深度探讨之前,有必要回顾蛋白质折叠的基本原理及其科研价值。蛋白质作为生命的基本构件,氨基酸链通过错综复杂的三维折叠,形成千变万化的功能结构。蛋白质的结构直接决定其功能。比如一把钥匙只能开一把锁,蛋白质也必须有正确的形状才能与特定分子结合。折叠错误可能导致蛋白质失效,引发疾病。因此,准确预测蛋白质结构,根据它的结构设计出有效的药物分子,不仅是理解生命运作机制的关键,也是生物制药与蛋白质工程领域的迫切需求,对推动科研发展具有举足轻重的意义。图片来源:https://www.sohu.com/a/511904965_12019518102AlphaFold3:生命分子交互的深度解析者在此背景下,AlphaFold3的面世,构建于AlphaFold2的坚实基础上,后者已经从本质上解决了从氨基酸序列到蛋白质三维结构预测的难题。AlphaFold3则进一步拓展了预测边界,涵盖了几乎全部生物分子类型及其相互作用的模型化,成为首个能以顶尖水平预测广泛分子间相互作用的系统。AlphaFold3一大亮点就是引入了扩散模型,该模型也被用于OpenAI的Sora、DELL3这样的通用图像大模型。尤为重要的是,AlphaFold3不仅预测结构,还提供预测的置信度评估,为科研人员筛选高可信度预测结果以进行后续实验提供了依据,极大地提升了研究效率。图片来源:参考资料303技术创新与现实考量并行尽管AlphaFold3在预测精度与应用范围上取得了革命性进展,但其运行所需的庞大计算资源与存储空间成为了实际应用中的考量因素,特别是对资源有限的研究机构而言。此外,面对含有大量可变结构域或高度柔性的蛋白质,预测的准确性仍面临挑战。RNA和DNA结构的预测虽有进步,但与蛋白质预测相比,其预测可信度依然较低。AlphaFold3聚焦于静态结构预测,而对于而蛋白质的动态行为捕捉和功能实现涉及复杂的分子间相互作用和构象变化,仍是当前模型面临的难题。对于罕见或未被充分研究的蛋白质,数据稀缺限制了预测的可靠性。蛋白质功能的全貌,还需考虑细胞环境、翻译后修饰等因素,都是需要AI模型进一步探索。最后,尽管AlphaFold3成果显著,实验验证作为理论预测的最终检验,其必要性不可替代。04结语:科技里程碑与持续探索总而言之,AlphaFold3在蛋白质结构预测上的成就,无疑是AI技术应用于生物信息科学领域的一项重要里程碑,但同时也揭示了未来研究的方向与挑战。它不仅是科技进步的象征,更是对未知世界持续探索精神的体现。随着技术的迭代与科学边界的拓宽,我们期待AlphaFold3及其后续发展能引领生物医药研究进入一个更加高效、精准的新时代。目前AlphaFold3没有免费开放,据了解NPAI天然产物AI研发平台的的分子对接应用了AlphaFold2的算法,可体验。图片来源:NPAIEngine天然产物AI研发平台-分子对接参考文献:1.Abramson,J.,Adler,J.,Dunger,J.et al.Accurate structure prediction of biomolecular interactions with AlphaFold 3.Nature(2024).https://doi.org/10.1038/s41586-024-07487-w2.Jumper,J.,Evans,R.,Pritzel,A.et al.Highly accurate protein structure prediction with AlphaFold.Nature 596,583-589(2021).https://doi.org/10.1038/s41586-021-03819-23.https://deepmind.google/discover/blog/alphafold-a-solution-to-a-50-year-old-grand-challenge-in-biology/4.https://golgi.sandbox.google.com/about声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。







 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划





