应用端销售规模放大的典型案例
根据默沙东发布的2022年度业绩报告,仑伐替尼为其带来了8.76亿美元的收入,是其在肿瘤领域获得增长的三大主力之一。
2022年1-2季度,仑伐替尼医院端销售已达到2021年全年院端销售额的80%,销售额为7.72亿人民币。
1、仑伐替尼上市历程
仑伐替尼Lenvima(商品名:乐卫玛)是一种酪氨酸激酶(RTK)受体抑制剂,最早由Eisai Co.开发,2015年2月获得FDA批准于美国上市,用于治疗难治性分化甲状腺癌。
2018年3月,Eisai与默沙东达成战略合作,在全球范围内开发和商业化Lenvima。同年9月Lenvima在中国获批进口上市(注册证号:H20180052),作为一种单药疗法,用于治疗既往未接受过全身系统治疗的不可切除的肝细胞癌患者。
根据其审评文件披露,在难治性分化甲状腺癌患者中,Lenvima可以显著延长患者的无进展生存期(治疗组vs对照组:18.3个月vs
3.6个月)。在晚期肝细胞肝癌患者中,Lenvima也可以显著延长患者的无进展生存期(治疗组vs对照组:7.3个月vs 3.6个月)。
在2021年公布的一项真实世界的临床实践中,相较于晚期肝细胞肝癌一线治疗药物索拉非尼,仑伐替尼可以降低患者的进展风险,并且安全性可控。
2、国内市场销售增长
国内市场,Lenvima的销售量处于增长状态(图1)。2018年Lenvima在中国地区的销售金额为1.05亿人民币,2021年为10.19亿人民币。2020年Lenvima在中国地区的销售同比增长率为37.97%。2020年底Lenvima宣布纳入国家医保。
2021年1月21日,Lenvima获得国药准字(注册证号:国药准字HJ20200044,国药准字HJ20200045)。同年,Lenvima销售同比增长率则达到了341.27%。因此,相较于全球市场,中国地区Lenvima的销售量仍然具有很大的增长空间。
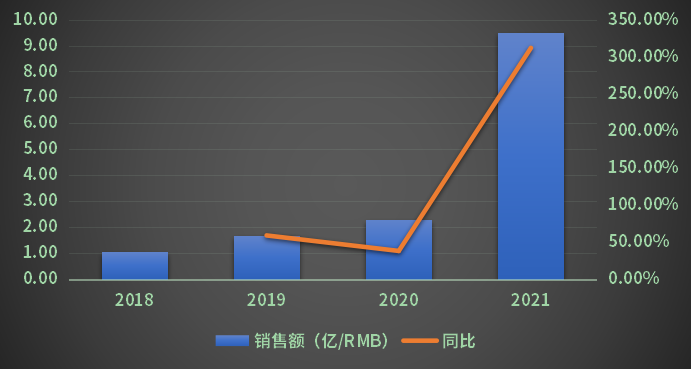
图1 Lenvima中国地区销售数据
3、位居全球销售额TOP榜
自2015年上市至2021年,Lenvima的销售量在全球仍然处于增长状态(图2)。2015年Lenvima的全球销售额为5.9亿人民币,而2021年,Lenvima的销售额已达到158.5亿人民币。2020年销售同比增长率为34.53%,2021年的销售同比增长率为29.63%,同比增长率有所放缓。
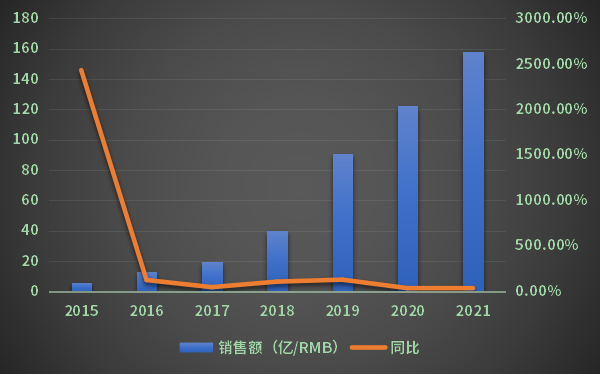
图2 Lenvima全球销售数据
4、联合用药:应用端销售规模放大
Lenvima最初获批作为一种单药疗法,用于难治性分化甲状腺癌。
2016年5月,美国FDA批准Lenvima联合依维莫司治疗既往至少用一种抗血管生成药物(如帕唑帕尼、索拉菲尼、舒尼替尼)治疗过的肾细胞癌患者。Lenvima与依维莫司联合用药体外可抑制人内皮细胞增殖、血管形成、VEGF号通路,体内可降低人肾细胞癌荷瘤小鼠的肿瘤体积,联合用药的抗血管生成与抗肿瘤活性大于单药使用。
2018年3月、8月和9月,Lenvima先后获得日本、美国、欧盟、中国批准,成为这些市场过去10年来,在全球范围内获批,用于晚期或不可切除性肝细胞肝癌的首个新的一线治疗药物。
2021年4月,Eisai与默沙东宣布,已在日本提交了一份申请,将Lenvima与抗PD-1疗法Keytruda(可瑞达,通用名pembrolizumab,帕博利珠单抗)联合用药,用于治疗晚期肾细胞癌患者。
2021年7月,FDA批准Keytruda与Lenvima联合用药方案,用于治疗既往在任何情况下接受系统治疗后疾病进展、不适合根治性手术或放疗、经检测证实不是微卫星高不稳定性(MSI-H)或不是错配修复缺陷(dMMR)的晚期子宫内膜癌患者(图3)。在这里,“不是MSI-H或不是dMMR”也被称为“非微卫星高不稳定性(non-MSI-H)或错配修复正常(pMMR)”。
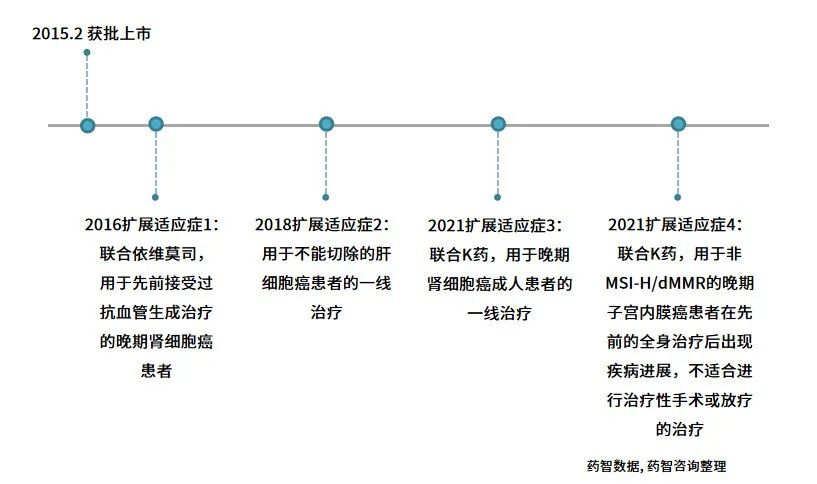
图3 Lenvima适应症扩展历程
目前,在全球范围内,Lenvima相关的正在开展的临床试验共计259个,分布在美国、中国、欧盟等多个地区(表1)。
表1 Lenvima相关全球临床试验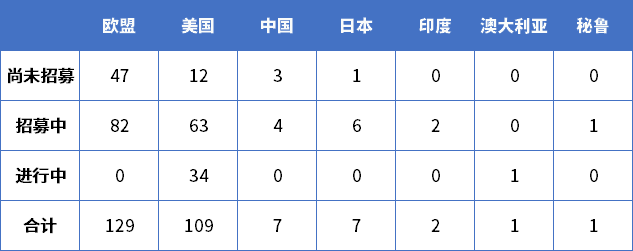
美国地区正在开展的临床试验多为联合治疗方案的探索,其中包含Lenvima与紫杉醇、顺铂、K药等药物的联合治疗方案。涉及瘤种更加广泛,涉及到黑色素瘤、乳腺癌与小细胞肺癌等多个瘤种。这些正在进行的临床试验表明,Lenvima在用药方案及适应症仍有很多的领域值得探索。这也表明,在将来,Lenvima或可为更多的肿瘤患者带来临床获益。
小结
Lenvima上市后,在药物适应症上进行积极扩展。从单一适用于分化甲状腺癌,扩展为适用于肝癌,肾癌和子宫内膜癌等多种癌症。适应症的增加也使得该药的目标人群得到了极大的扩展。肝癌是我国发病率第四的恶性肿瘤,患病人群极其庞大,约占世界肝癌总患病人数的一半。2018年Lenvima在中国获批上市,用于治疗既往未接受过全身系统治疗的不可切除的肝细胞癌患者。但其销售额迎来爆发式增长是在2020年底纳入国家医保目录之后。
此外,Lenvima还在积极寻找用药方案上的突破。通过与keytruda“靶向+免疫”强强联合,使多种癌症患者的中位生存期得到了显著延长。在2021年,FDA批准了Lenvima与keytruda的联合诊疗方案。适应症扩展及用药方案的多样化都为Lenvima销售的稳定增长奠定了基石。这也说明,药物的上市只是开始,积极寻找更多的用药人群是给企业带来更加长久收益的一种方式,也可以为患者带来更多获益。
声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智咨询立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请点击右侧在线咨询反馈。
 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划
想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们
