九种候选药物管线,六种处于临床阶段。
据港交所官网显示,2月26日,江苏荃信生物医药股份有限公司–B通过港交所主板IPO聆讯,即将上市。
据悉,荃信生物成立于2015年,是一家完全专注于自身免疫及过敏性疾病生物疗法的临床阶段生物科技公司,布局皮肤、风湿、呼吸道及消化道疾病四大疾病领域。
据其官网显示,基于完整的自主创新能力,荃信生物已形成两个核心产品QX002N及QX005N,以及七个其他候选药物的产品管线。其中1个品种BLA已受理,1个品种处于临床3期,4个品种分别处于临床2期及1期,适应症覆盖银眉病、特应性皮炎、强直性脊柱炎、系统性红斑狼疮、哮喘、炎症性肠病等皮肤、风湿、呼吸、消化四大疾病领域,是国内在自身免疫及过敏性疾病领域内获得IND批准最多的公司之一。
荃信生物产品管线
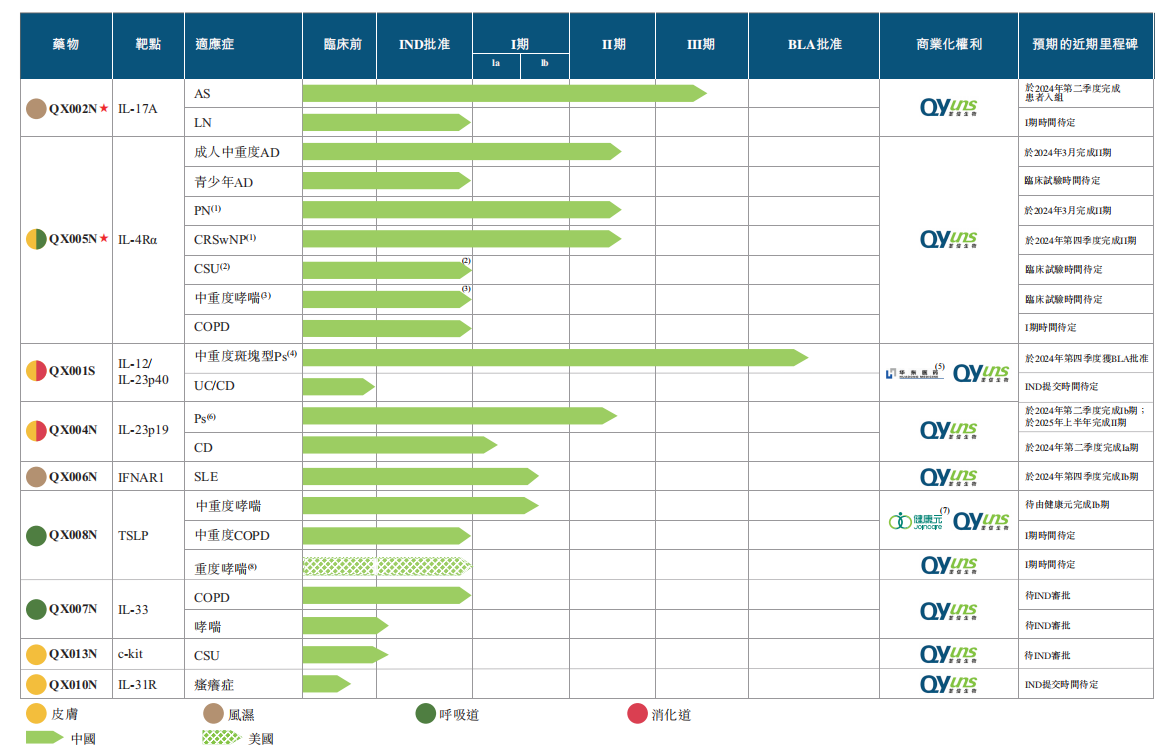
图片来源:荃信生物聆讯资料
具体而言,QX001S(一种用于治疗银屑病(Ps)的IL-12/IL-23p40抑制剂),是首个在中国提交BLA的国产乌司奴单抗生物类似药,且可能是在中国首个获批的乌司奴单抗生物类似药之一;QX002N(一种处于III期临床试验的IL-17A抑制剂,治疗强直性脊柱炎(AS)方面拥有良好的疗效);QX005N(一种阻断IL-4Rα的单克隆抗体(mAb),而IL-4Rα是一种经充分验证可应用于广泛适应症的广泛作用靶点)。QX005N是中国针对特应性皮炎(AD)的最成熟候选生物药物之一,也是国内公司开发首款针对结节性痒疹(PN)进行临床试验的候选生物药物。
QX002N是荃信生物的核心产品之一,是一种靶向IL-17A的高亲和力单克隆抗体,IL-17A在多种自身免疫性疾病的发病机制中起着关键作用。IL-17A抑制剂连同TNF-α抑制剂,获现行的临床指南推荐用于接受一线传统治疗后仍有高疾病活动度的AS患者的二线治疗方法。在两类生物疗法中,IL-17A抑制剂对TNF-α抑制剂不耐受或不能达到充分疾病控制的患者有明显的临床益处。
荃信生物已取得针对强直性脊柱炎及狼疮性肾炎的QX002N的IND批准。QX002N在针对AS的Ib期及II期临床试验中显示出良好疗效。在Ib期临床试验中,每2周接受一次QX002N(160mg)的受试者第16周的ASAS20及ASAS40应答率分别为62.5%及37.5%。在II期临床试验中,每4週一次接受QX002N(160mg)的受试者在第16週时的ASAS20及ASAS40应答率分别达到60.0%及40.0%。
据聆讯资料显示,荃信生物与国家药监局进行了QX002NIII期前谘询,而国家药监局在其于2023年7月发出的官方回覆中并无提出任何重大问题,而且确认其对开展有关试验并无持反对意见。QX002N于2023年9月启动III期临床试验,并预计在2025年下半年完成。
QX005N是荃信生物的另一个核心产品,QX005N旨在抑制IL-4Rα,而IL-4Rα是一种经充分验证可应用于广泛适应症的广泛作用靶点。由于IL-4Rα控制IL-4及IL-13的信号传导,这对于2型炎症的发生至关重要,因此其已成为相关适应症中新药开发的关键靶点。
根据弗若斯特沙利文的资料,截至目前,IL-4Rα抑制剂已获批准或正在开发中,用于治疗全球20种适应症。度普利尤单抗为首个获FDA批准的IL-4Rα抑制剂,是全球最畅销的过敏性疾病生物药物之一,2023年的年销售额为107.15亿欧元(约117.17亿美元)。
目前,荃信生物已获得七种QX005N(即成人AD、青少年AD、PN、CRSwNP、CSU、哮喘及COPD)的IND批准,是中国IL-4Rα靶向候选药物中适应症最多的药物。
据荃信生物聆讯资料显示QX005N在其进行的Ia期及Ib期临床试验中显示出对治疗AD具良好的安全性及疗效。在中重度AD患者的Ib期临床试验中,在300mg和600mg组于第12週中有75.0%的受试者达到湿疹面积及严重程度指数-75(EASI-75)反应(定义为EASI分数较基线提高75%或以上),而50.0%的受试者达到研究者整体评估(IGA)分数(0或1),且没有明显增加安全风险。
荃信生物已开始针对AD的II期临床试验,并已于2023年2月完成患者入组。此外,我们于2023年2月开始针对PN的II期临床试验。根据弗若斯特沙利文的资料,QX005N是首个由中国国内公司开发并在中国开始PN临床试验的候选生物药物。于2024年1月,药审中心授予QX005N治疗PN的突破性疗法资格认定,标志其相较现有治疗方法更卓越的临床效益。该资格认定旨在加快创新药物(该等药物于解决严重疾病方面展现巨大潜力)的开发及监管审查。2023年4月荃信生物开始QX005N用于治疗CRSwNP的II期临床试验。
声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智咨询立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请点击右侧在线咨询反馈。
 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划
想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们
