压力接踵而至
当下最火药物之一,非司美格鲁肽莫属。
2023年,司美格鲁肽总销售额为1458.11亿丹麦克朗(约211.4亿美元,按1丹麦克朗=0.145美元计算),尤其是减肥针Wegovy销售额较2022年同比上涨407%。
然而,司美格鲁肽也面临中国专利到期(2026年到期)的严峻考验,及其它竞争者如替尔泊肽的直接压力等。
销售额大涨407%后,司美格鲁肽的下一城在哪?2023年,MNC的“重磅炸弹药物”们还有哪些?
01
司美格鲁肽的下一城
司美格鲁肽有Ozempic、Rybelsus和Wegovy三种获批形式。
Ozempic于2017年12月和2021年4月在美国和中国获批上市,每周皮下注射用于治疗2型糖尿病患者,2023年Ozempic销售额同比增长60%(按丹麦克朗计算,下同)至957.18亿丹麦克朗(138.8亿美元)[1]。
Rybelsus于2019年9月和2024年1月26日在美国和中国获批上市,每日口服用于治疗2型糖尿病,是全球首个获批的口服GLP-1药物,2023年Rybelsus销售额同比增长66%至187.5亿丹麦克朗(27.2亿美元)。
Wegovy于2021年6月被FDA批准上市,每周皮下注射用于治疗肥胖症患者,成为2014年以来首款获批的减肥新药,2023年6月份,诺和诺德在国内递交了Wegovy的上市申请并获国家药监局受理。
2023年Wegovy销售额同比增长407%至313.43亿丹麦克朗(45.4亿美元)。
值得注意的是,司美格鲁肽不仅有降糖减重作用,在阿尔兹海默症、心血管疾病、慢性肾病和非酒精性脂肪性肝炎等疾病也显示出良好的疗效。
然而,司美格鲁肽也面临专利到期和其它竞争者如替尔泊肽的压力,Ozempic、Rybelsus和Wegovy在中国的专利将于2026年到期。
目前,口服降糖药Rybelsus获批的规格有3mg、7mg和14mg,因需要每日给药及上市时间晚等原因,Rybelsus的销售额远远低于Ozempic,为了进一步提高疗效以及延长专利保护等,诺和诺德正在开发高剂量口服司美格鲁肽。
2023年,诺和诺德公布的两项用于评估高剂量口服司美格鲁肽如25mg、50mg疗效的PIONEERPLUS和OASIS1试验都取得积极效果。
另一方面,诺和诺德在开发司美格鲁肽复方制剂,如CagriSema和IcoSema。
CagriSema是由胰淀素类似物Cagrilintide和司美格鲁肽组成的的复方合剂,2023年8月份,柳叶刀上一篇文章报道了2.4mgCagrilintide和2.4mg司美格鲁肽组成的复方制剂CagriSema每周一次联合给药有效性和安全性的积极结果。
研究结果显示:CagriSema组(司美格鲁肽2.4mg和Cagrilintide2.4mg组成)、司美格鲁肽2.4mg组、cagrilintide2.4mg组的HbA1c分别下降2.2%、1.8%和0.9%,体重分别降低15.6%、5.1%和8.1%[2]。
IcoSema是由司美格鲁肽与基础胰岛素依柯胰岛素(insulinicodec)以固定比例组成的联合制剂。
2024年1月8日,诺和诺德公布了每周一次的IcoSema的COMBINE33a期试验的顶线结果:IcoSema组和对照组HbA1c分别降低了1.47%和1.40%,IcoSema组体重降低了3.6kg,而对照组体重增加了3.2kg(图1)[3]。
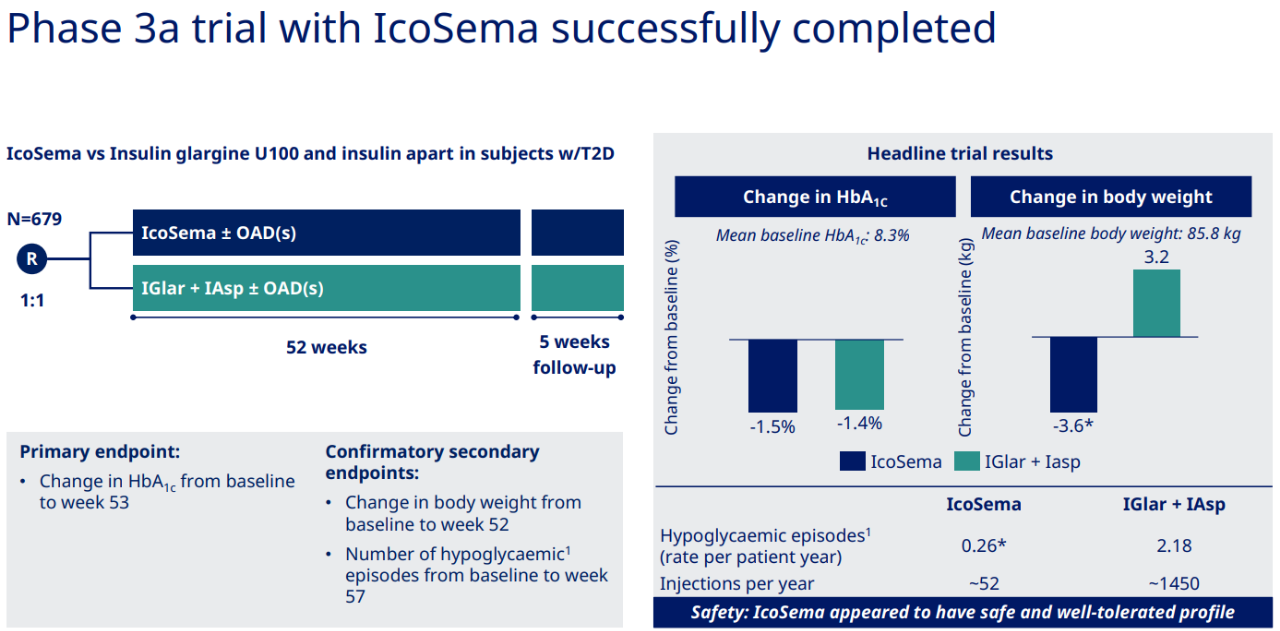
图1 COMBINE3试验结果
图片来源:参考文献3
02
K药问鼎“药王”宝座
2023年,除了司美格鲁肽外,MNC的“重磅炸弹药物”们还有哪些?
K药是默沙东最重磅的药物,2023年全球销售额达到250亿美元,同比增长19%(剔除汇率影响,销售额增长22%),打败了昔日“药王”修美乐(2023年营收144.04亿美元)[4]。
K药于2014年9月首次获美国FDA,用于晚期恶性黑色素瘤患者,自首次获批之后,K药的获批范围不断扩大,据不完全统计,截至2023年12月,K药在美国FDA共被批准19个癌种,其中2个血液肿瘤,17个实体瘤,合计约30多个适应症,包括黑色素瘤、非小细胞肺癌、头颈部鳞癌、经典霍奇金淋巴瘤、原发性纵隔大B细胞淋巴瘤和6尿路上皮癌等[5]。
K药之所以畅销,离不开其优异的疗效,如用于评估对肾细胞癌患者辅助免疫治疗效果的KEYNOTE-564试验在对30个月的研究数据进行事后分析时发现,K药组存活且无复发的参与者预计比例为75.2%,高于安慰剂组的65.5%,K药可以有效地改善肾细胞癌患者的无病生存期。
除此之外,K药在新适应症上也有重大进展,K药联合Padcev一线治疗局部晚期或转移性尿路上皮癌成人患者于2023年12月15日被FDA批准;K药联合化疗用于一线治疗表达PD-L1(CPS≥1)和晚期胆道癌的晚期HER2阴性胃癌或胃或胃食管交界处(GEJ)腺癌患者于2023年12月18日被欧盟批准;K药与放化疗(CRT)联合用于治疗FIGO(国际妇产科学联合会)2014年III-IVA期宫颈癌患者于2024年1月12日被FDA批准;K药联合吉西他滨和顺铂一线治疗局部晚期或转移性胆道癌患者于2024年2月4日被NMPA批准。
默沙东另一主要药物收入来源于GARDASIL/GARDASIL9疫苗,2023年第4季度,GARDASIL/GARDASIL9的销售额增长27%至19亿美元,2023年全球销售额增长29%至89亿美元,剔除汇率影响,销售额增长33%(图2)[6]。
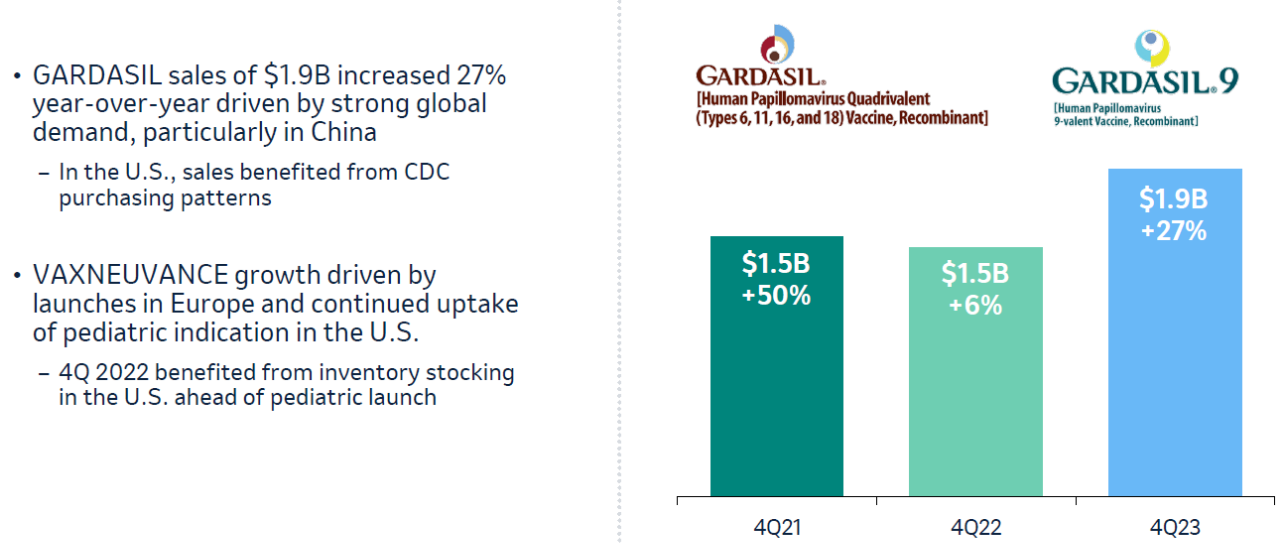
图2 GARDASIL/GARDASIL9 2021-2023第4季度销售额
图片来源:参考文献6
GARDASIL/GARDASIL9是由默沙东研发四价/九价HPV疫苗,该疫苗的强劲增长主要得益于市场需求的增加,尤其是中国。
2023年1月,默沙东与智飞生物续签代理协议至2026年末,协议产品包括四价/九价HPV疫苗、五价轮状病毒疫苗等,其中HPV疫苗2023-2026年采购金额分别276.66亿元、326.26亿元、260.33亿元以及178.92亿元,四年间HPV采购金额超千亿元。
国内尚无国产九价HPV疫苗上市,市场是只有智飞生物代理的九价HPV疫苗,该九价HPV疫苗于2022年被NMPA扩展适用人群至9-45岁适龄女性范围,并且于2024年1月获得NMPA批准9至14岁女性二剂次接种程序(0,6~12月)。
03
度普利尤单抗大卖116亿美元
度普利尤单抗是赛诺菲最重磅产品,在自免领域尤其是特应性皮炎适应症上取得巨大成功,2023年第4季度销售额为29.9亿欧元(32.3亿美元,按汇率1欧元=1.08美元换算),2023年销售额达到107.15亿欧元(115.7亿美元,图3)[7]。
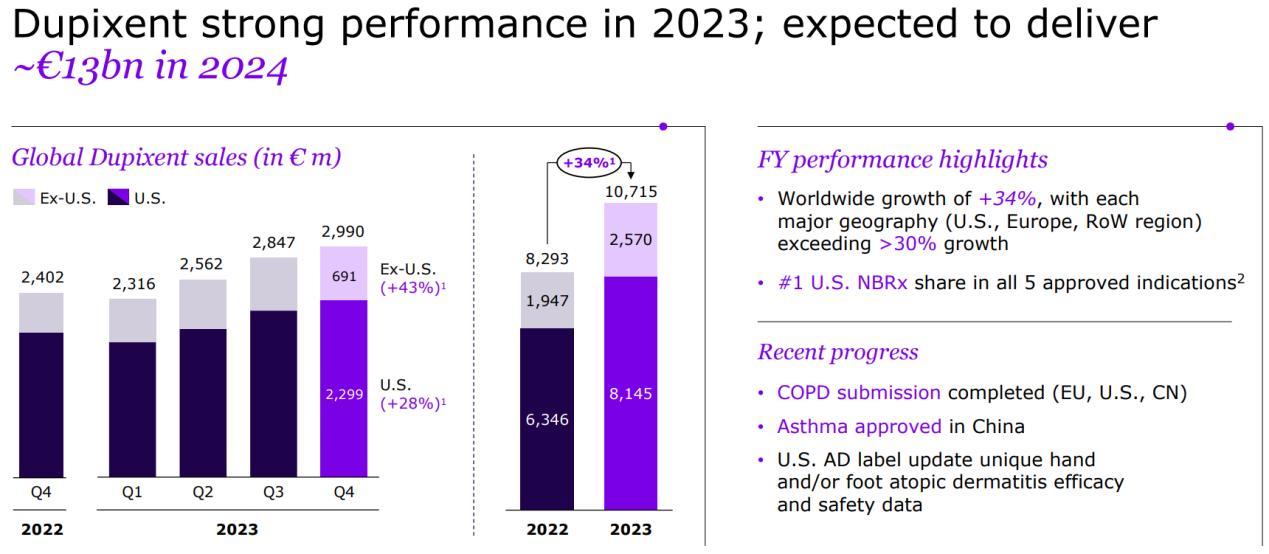
图3 度普利尤单抗销售额
图片来源:参考文献7
2023年,度普利尤单抗在也慢性阻塞性肺病(COPD)适应症上取得重大进展,先后在BOREAS、NOTUS临床试验取得积极结果。
BOREAS试验结果显示:度普利尤单抗组的中度或重度加重年化发生率为0.78,安慰剂组为1.10,从基线到第12周,支气管扩张剂前FEV1的最小二乘均值(LSMean)增加160ml,安慰剂组增加77ml,这一差异一直持续到第52周[8]。
度普利尤单抗是第一个也是唯一一个在COPD的中度或重度急性加重(呼吸道症状的快速和急性恶化)(30%)方面具有临床意义和高度显着减少的生物制剂。
随后2023年11月27日,度普利尤单抗第2项3期治疗COPD的NOTUS试验以压倒性的疗效达到了其主要终点,与安慰剂相比,度普利尤单抗使中度至重度COPD患者急性加重显著降低了34%,进一步证实了具有里程碑意义的BOREAS关键试验的结果。
除此之外,度普利尤单抗也获批了很多新适应症,如2023年9月,度普利尤单抗获NMPA批准用于治疗成人结节性痒疹;2023年11月,度普利尤单抗获NMPA批准用于12岁及以上青少年和成人2型哮喘患者的维持治疗;2024年1月,度普利尤单抗获FDA批准用于治疗1至11岁、体重至少15公斤、嗜酸性粒细胞性食管炎(EoE)的儿童患者等。
参考文献
1.NovoNordiskAnnualReport2023
2.JuanPFrias,SrikanthDeenadayalan,LarsErichsen,FilipKKnop,IldikoLingvay,StanislavaMacura,ChantalMathieu,SueDPedersen,MelanieDavies,Efficacyandsafetyofco-administeredonce-weeklycagrilintide2·4mgwithonce-weeklysemaglutide2·4mgintype2diabetes:amulticentre,randomised,double-blind,active-controlled,phase2trial3.
3.NovoNordisk–afocusedhealthcarecompanyInvestorpresentationFullyear2023
4.MerckAnnouncesFourth-QuarterandFull-Year2023FinancialResults
5.IO笔记:K药2023再创新高!全球销售额突破250亿美元&K药资料大全盘点309
6.MerckQ42023EarningsFebruary1,2024
7.SanofiQ42023Results
8.SuryaP.Bhatt,M.D.,et.al,DupilumabforCOPDwithType2InflammationIndicatedbyEosinophilCounts,NEnglJMed2023;389:205-214
声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智咨询立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请点击右侧在线咨询反馈。
 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划
想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们
