2024年上半年,科伦博泰交出了靓丽的成绩单:实现总收入13.82亿元,同比增长32.2%;净利润3.1亿元,实现扭亏为盈;调整后净利润3.86亿元,同比增长1068%。一连串的利好,使得今年以来科伦博泰股价累计涨幅超过60%,总市值达377.5亿港元,成为众多港股18A公司中的佼佼者。科伦博泰之所以能扭亏为盈,得益于与默沙东达成多笔重大授权合作。截至2024年6月30日,科伦博泰实现总收入13.82亿元,相较上年同期的10.46亿元增长32.2%。这主要得益于公司在今年上半年就多条合作管线收到默沙东总额为9000万美元(约合人民币6.41亿元)的里程碑付款。2022年,科伦博泰共与默沙东达成3项总额超百亿美元的交易,成为首家将内部发现及开发的ADC候选药物授权给前十大生物制药跨国公司的中国公司。而且,除了默沙东以外,近年来科伦博泰还与和铂医药、Ellipses Pharma等达成多项BD合作。今年上半年,科伦博泰的总收入主要来自许可及合作协议收入13.78亿元,以及研发服务收入481万元,进一步扩充了现金流。截至今年6月30日,公司现金及金融资产达到28.85亿元,相较2023年底增长15.9%。尤其是,科伦博泰正处于商业化前夕,目前已有4款产品申报上市,分别为sac-TMT(SKB264/MK-2870,芦康沙妥珠单抗)、A166、A167和A140,预计今年下半年或2025年上半年在中国市场实现商业化。为了做好产品上市前的准备工作,科伦博泰正在扩大商业化团队,进行招聘员工及产品上市前营销活动,计划到2024年底扩张至约400人。其中,SKB264便是商业化的重头戏。
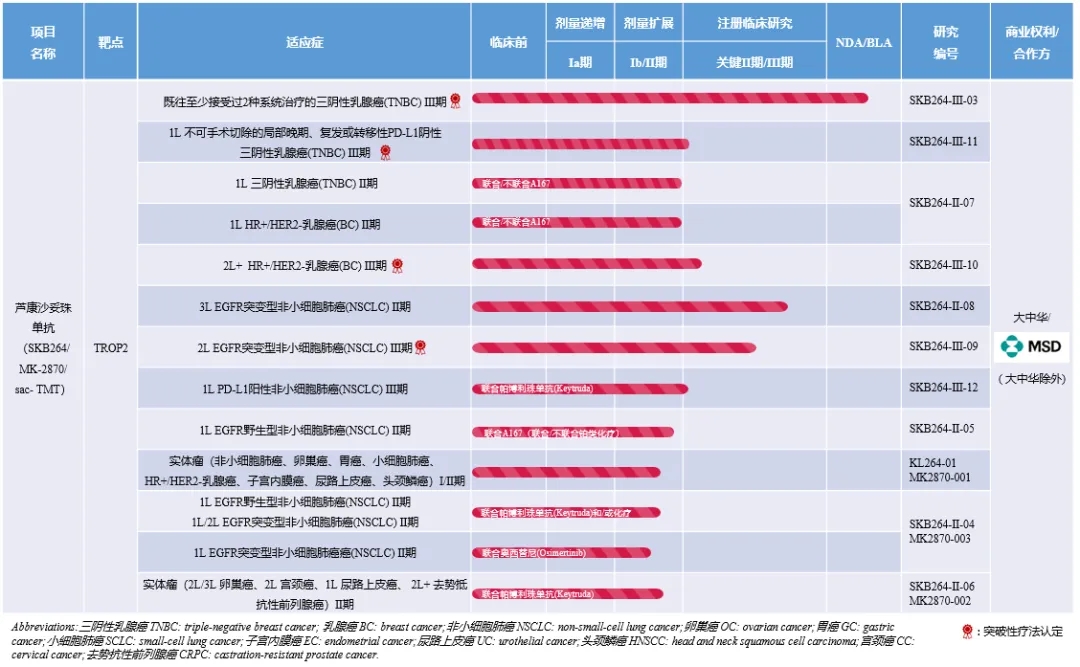
SKB264是科伦博泰用于治疗晚期实体瘤的核心产品,具备BIC潜力,有望在今年内获批用于治疗三阴性乳腺癌,成为国产首款TROP2 ADC。近日,SKB264还获得中国国家药监局(NMPA)受理第2项适应症的上市申请,用于EGFR-TKI和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。肺癌是全球最高发的癌种,患者数量庞大,且亟待解决耐药性问题。若成功获批,SKB264有望填补EGFR突变NSCLC患者靶向治疗失败后的临床空白。当前,全球TROP2 ADC领域仅有吉利德的Trodelvy(戈沙妥珠单抗)获批上市,该药2023年销售额突破10亿美元;其他已处于临床Ⅲ期及以上的竞品,还有阿斯利康/第一三共Dato-Dxd、诗健生物ESG401、恒瑞医药SHR-A1921,其中Dato-Dxd用于乳腺癌的上市申请已于今年3月获NMPA受理。值得一提的是,截至今年6月30日,默沙东已针对SKB264启动了10项全球III期临床研究,作为单药疗法或联合帕博利珠单抗(K药)或其他药物用于肺癌、胃癌、宫颈癌等多种适应症。这无疑为SKB264成为大药增添了许多筹码。除SKB264外,还有3款产品已提交上市申请,包括A166(舒泰莱)、A167(科泰莱)和A140(达泰莱)。A166为差异化HER2 ADC,是科伦博泰在ADC领域的另一款核心产品,用于治疗三线及以上晚期HER2阳性(HER2+)乳腺癌(BC)的NDA申请已于2023年5月获NMPA受理。A166的差异化特点体现在结构设计上,通过采用高度细胞毒性的有效载荷,以及独特的位点特异性偶联技术实现一致的低DAR,使其在低DAR下也能显著杀死肿瘤细胞,并确保安全性。据临床研究表明,A166表现出相对已上市的3款HER2 ADC(Kadcyla、Enhertu、维迪西妥单抗)的差异化安全性,在非头对头交叉试验比较中血液、胃肠道及肺毒性发生率较低。另外,科伦博泰还在中国开展探索A166对照T-DM1(Kadcyla)用于2L+晚期HER2+BC的III期临床研究,以及多项在中国进行的针对晚期HER2+实体瘤(包括胃癌、结直肠癌)的1b期临床试验。
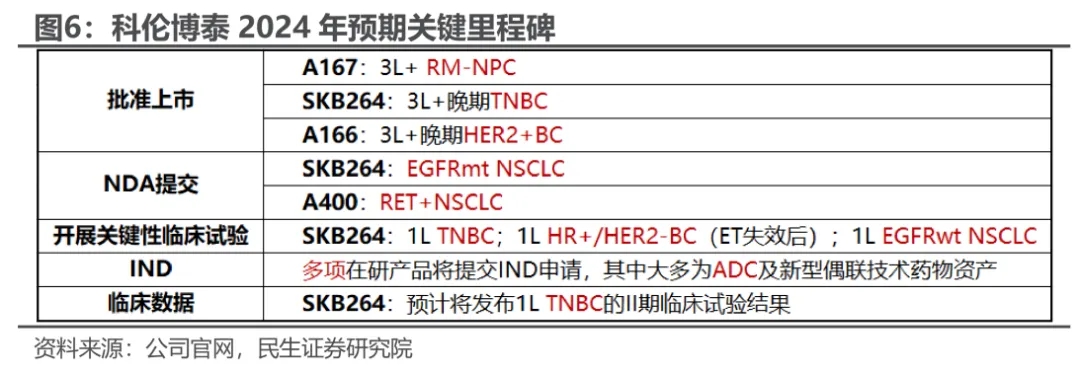
A167(塔戈利单抗)是科伦博泰自研的PD-L1单抗,已于2021年11月向NMPA递交了基于一项鼻咽癌关键Ⅱ期研究的附条件申请的NDA申请。今年5月,NMPA还受理了A167一线治疗鼻咽癌的注册性Ⅲ期研究的NDA申请。作为公司免疫疗法的支柱,A167还具备与ADC和其他肿瘤资产联合使用的治疗潜力,正在开展联合SKB264治疗非小细胞肺癌(NSCLC)和三阴性乳腺癌的临床研究。根据2024ASCO年会上公布的SKB264联合A167用于一线治疗晚期NSCLC患者的Ⅱ期研究结果显示:就接受该联合疗法Q3W的患者而言,ORR为48.6%,DCR为94.6%,中位PFS为15.4个月;就接受该联合疗法Q2W的患者而言,ORR为77.6%,DCR为100%,截止时尚未达到中位PFS。A140是靶向EGFR的西妥昔单抗生物类似药,已于去年9月向NMPA递交了治疗RAS野生型结直肠癌(mCRC)及头颈部鳞状细胞癌(HNSCC)的NDA申请。2023年,默克/礼来原研的西妥昔单抗全球销售额约为17亿美元,中国销售额超过20亿元。不过,这一赛道竞争较为激烈,先声药业与迈博药业合作研发的恩立妥(通用名:西妥昔单抗β注射液),已率先于今年6月获批上市,适应症为与FOLFIRI方案联合用于一线治疗RAS/BRAF基因野生型的转移性结直肠癌;后来者还有三生国健、复宏汉霖、神州细胞和石药集团等一众药企。尽管科伦博泰尚未有产品实现商业化,但已凭借持续不断的合作收入实现扭亏为盈,而且合作伙伴不限于默沙东。为了延长K药的生命周期,默沙东这两年频繁押注IO+ADC,科伦博泰手里的ADC资产便是其青睐对象。这得益于科伦博泰不断探索最优ADC管线组合,不时调整优化与默沙东早期管线的合作范围。科伦博泰建立了3个分别专注于ADC、大分子及小分子技术的核心平台,其中ADC平台采取多管齐下的战略推进。例如,在肿瘤疾病领域,开发靶向新型靶点的单抗、双表位和双抗ADC,同时开发具有创新化合物结构及除细胞毒素以外的多种有效载荷的ADC衍生物,包括放射性核素偶联药物(RDC)、免疫刺激ADC(iADC)及降解剂-抗体结合物(DAC)等。随着双抗ADC药物展现出治疗潜力,近日双方又达成了新的合作:默沙东以3750万美元首付款引进科伦博泰创新双抗ADC药物SKB571在大中华区以外的全球权益,后续还将支付里程碑付款,以及商业化后支付按净销售额计算的分级特许权使用费。SKB571主要针对肺癌、消化道肿瘤等多种实体瘤,已在临床前研究展现出良好的抗肿瘤效果及安全性,将于近期递交IND申请。
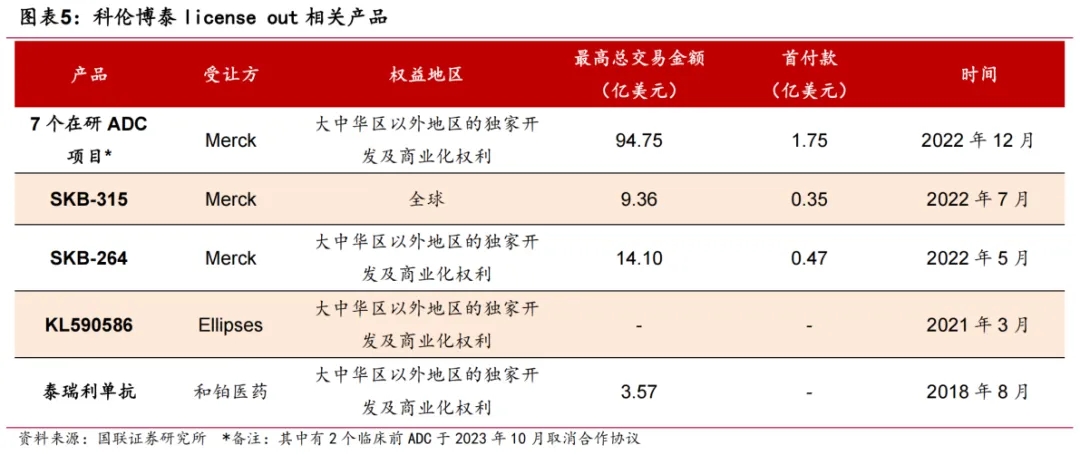
除大分子药物外,科伦博泰还在小分子药物领域达成过BD交易。早在2021年,科伦博泰就与Ellipses Pharma达成BD交易,将新一代选择性RET小分子激酶抑制剂A400/EP0031在大中华区及部分亚洲国家之外的全球权益授予后者。A400定位为首款国产治疗NSCLC、甲状腺髓样癌(MTC)及其他RET变异高患病率实体瘤的下一代选择性RET抑制剂,此前接连获FDA授予孤儿药认定,用于治疗RET融合阳性实体瘤,获FDA快速通道资格认定,用于治疗RET融合阳性NSCLC。今年4月,A400获FDA批准进入Ⅱ期临床开发。除此以外,科伦博泰还有多款小分子药物进入临床阶段,包括A296、A223、A277。A296为非环二核苷酸(non-CDN)类小分子化合物,是具有全新结构、体内外药效活性显著、结构稳定且可兼顾瘤内给药及系统给药的新一代STING激动剂,正在开展2项实体瘤I期临床研究。A223是靶向JAK1和JAK2激酶的选择性抑制剂,正在开展针对类风湿关节炎和斑秃的Ⅱ期临床;A277为选择性外周κ阿片受体激动剂,具有显著的抗瘙痒效果,正在开展治疗尿毒症瘙痒的Ⅱ期研究。不难预见,随着多款产品迈入商业价值兑现期,以及后续可能产生的合作收入,科伦博泰将迎来“里程碑+商业化”的稳健发展时期。
参考资料:
1.科伦博泰公告、财报、官微
2.民生证券、国联证券研报
声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智咨询立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请点击右侧在线咨询反馈。
继科伦药业、川宁生物后,科伦博泰也上岸了。2024年上半年,科伦博泰交出了靓丽的成绩单:实现总收入13.82亿元,同比增长32.2%;净利润3.1亿元,实现扭亏为盈;调整后净利润3.86亿元,同比增长1068%。一连串的利好,使得今年以来科伦博泰股价累计涨幅超过60%,总市值达377.5亿港元,成为众多港股18A公司中的佼佼者。实现扭亏为盈,SKB264拿下第二个NDA科伦博泰之所以能扭亏为盈,得益于与默沙东达成多笔重大授权合作。截至2024年6月30日,科伦博泰实现总收入13.82亿元,相较上年同期的10.46亿元增长32.2%。这主要得益于公司在今年上半年就多条合作管线收到默沙东总额为9000万美元(约合人民币6.41亿元)的里程碑付款。2022年,科伦博泰共与默沙东达成3项总额超百亿美元的交易,成为首家将内部发现及开发的ADC候选药物授权给前十大生物制药跨国公司的中国公司。而且,除了默沙东以外,近年来科伦博泰还与和铂医药、Ellipses Pharma等达成多项BD合作。今年上半年,科伦博泰的总收入主要来自许可及合作协议收入13.78亿元,以及研发服务收入481万元,进一步扩充了现金流。截至今年6月30日,公司现金及金融资产达到28.85亿元,相较2023年底增长15.9%。尤其是,科伦博泰正处于商业化前夕,目前已有4款产品申报上市,分别为sac-TMT(SKB264/MK-2870,芦康沙妥珠单抗)、A166、A167和A140,预计今年下半年或2025年上半年在中国市场实现商业化。为了做好产品上市前的准备工作,科伦博泰正在扩大商业化团队,进行招聘员工及产品上市前营销活动,计划到2024年底扩张至约400人。其中,SKB264便是商业化的重头戏。SKB264研发情况图片来源:科伦博泰官网SKB264是科伦博泰用于治疗晚期实体瘤的核心产品,具备BIC潜力,有望在今年内获批用于治疗三阴性乳腺癌,成为国产首款TROP2 ADC。近日,SKB264还获得中国国家药监局(NMPA)受理第2项适应症的上市申请,用于EGFR-TKI和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。肺癌是全球最高发的癌种,患者数量庞大,且亟待解决耐药性问题。若成功获批,SKB264有望填补EGFR突变NSCLC患者靶向治疗失败后的临床空白。当前,全球TROP2 ADC领域仅有吉利德的Trodelvy(戈沙妥珠单抗)获批上市,该药2023年销售额突破10亿美元;其他已处于临床Ⅲ期及以上的竞品,还有阿斯利康/第一三共Dato-Dxd、诗健生物ESG401、恒瑞医药SHR-A1921,其中Dato-Dxd用于乳腺癌的上市申请已于今年3月获NMPA受理。值得一提的是,截至今年6月30日,默沙东已针对SKB264启动了10项全球III期临床研究,作为单药疗法或联合帕博利珠单抗(K药)或其他药物用于肺癌、胃癌、宫颈癌等多种适应症。这无疑为SKB264成为大药增添了许多筹码。商业化前夕除SKB264外,还有3款产品已提交上市申请,包括A166(舒泰莱)、A167(科泰莱)和A140(达泰莱)。A166为差异化HER2 ADC,是科伦博泰在ADC领域的另一款核心产品,用于治疗三线及以上晚期HER2阳性(HER2+)乳腺癌(BC)的NDA申请已于2023年5月获NMPA受理。A166的差异化特点体现在结构设计上,通过采用高度细胞毒性的有效载荷,以及独特的位点特异性偶联技术实现一致的低DAR,使其在低DAR下也能显著杀死肿瘤细胞,并确保安全性。据临床研究表明,A166表现出相对已上市的3款HER2 ADC(Kadcyla、Enhertu、维迪西妥单抗)的差异化安全性,在非头对头交叉试验比较中血液、胃肠道及肺毒性发生率较低。另外,科伦博泰还在中国开展探索A166对照T-DM1(Kadcyla)用于2L+晚期HER2+BC的III期临床研究,以及多项在中国进行的针对晚期HER2+实体瘤(包括胃癌、结直肠癌)的1b期临床试验。图片来源:民生证券研报A167(塔戈利单抗)是科伦博泰自研的PD-L1单抗,已于2021年11月向NMPA递交了基于一项鼻咽癌关键Ⅱ期研究的附条件申请的NDA申请。今年5月,NMPA还受理了A167一线治疗鼻咽癌的注册性Ⅲ期研究的NDA申请。作为公司免疫疗法的支柱,A167还具备与ADC和其他肿瘤资产联合使用的治疗潜力,正在开展联合SKB264治疗非小细胞肺癌(NSCLC)和三阴性乳腺癌的临床研究。根据2024ASCO年会上公布的SKB264联合A167用于一线治疗晚期NSCLC患者的Ⅱ期研究结果显示:就接受该联合疗法Q3W的患者而言,ORR为48.6%,DCR为94.6%,中位PFS为15.4个月;就接受该联合疗法Q2W的患者而言,ORR为77.6%,DCR为100%,截止时尚未达到中位PFS。A140是靶向EGFR的西妥昔单抗生物类似药,已于去年9月向NMPA递交了治疗RAS野生型结直肠癌(mCRC)及头颈部鳞状细胞癌(HNSCC)的NDA申请。2023年,默克/礼来原研的西妥昔单抗全球销售额约为17亿美元,中国销售额超过20亿元。不过,这一赛道竞争较为激烈,先声药业与迈博药业合作研发的恩立妥(通用名:西妥昔单抗β注射液),已率先于今年6月获批上市,适应症为与FOLFIRI方案联合用于一线治疗RAS/BRAF基因野生型的转移性结直肠癌;后来者还有三生国健、复宏汉霖、神州细胞和石药集团等一众药企。再携手默沙东尽管科伦博泰尚未有产品实现商业化,但已凭借持续不断的合作收入实现扭亏为盈,而且合作伙伴不限于默沙东。为了延长K药的生命周期,默沙东这两年频繁押注IO+ADC,科伦博泰手里的ADC资产便是其青睐对象。这得益于科伦博泰不断探索最优ADC管线组合,不时调整优化与默沙东早期管线的合作范围。科伦博泰建立了3个分别专注于ADC、大分子及小分子技术的核心平台,其中ADC平台采取多管齐下的战略推进。例如,在肿瘤疾病领域,开发靶向新型靶点的单抗、双表位和双抗ADC,同时开发具有创新化合物结构及除细胞毒素以外的多种有效载荷的ADC衍生物,包括放射性核素偶联药物(RDC)、免疫刺激ADC(iADC)及降解剂-抗体结合物(DAC)等。随着双抗ADC药物展现出治疗潜力,近日双方又达成了新的合作:默沙东以3750万美元首付款引进科伦博泰创新双抗ADC药物SKB571在大中华区以外的全球权益,后续还将支付里程碑付款,以及商业化后支付按净销售额计算的分级特许权使用费。SKB571主要针对肺癌、消化道肿瘤等多种实体瘤,已在临床前研究展现出良好的抗肿瘤效果及安全性,将于近期递交IND申请。图片来源:国联证券研报除大分子药物外,科伦博泰还在小分子药物领域达成过BD交易。早在2021年,科伦博泰就与Ellipses Pharma达成BD交易,将新一代选择性RET小分子激酶抑制剂A400/EP0031在大中华区及部分亚洲国家之外的全球权益授予后者。A400定位为首款国产治疗NSCLC、甲状腺髓样癌(MTC)及其他RET变异高患病率实体瘤的下一代选择性RET抑制剂,此前接连获FDA授予孤儿药认定,用于治疗RET融合阳性实体瘤,获FDA快速通道资格认定,用于治疗RET融合阳性NSCLC。今年4月,A400获FDA批准进入Ⅱ期临床开发。除此以外,科伦博泰还有多款小分子药物进入临床阶段,包括A296、A223、A277。A296为非环二核苷酸(non-CDN)类小分子化合物,是具有全新结构、体内外药效活性显著、结构稳定且可兼顾瘤内给药及系统给药的新一代STING激动剂,正在开展2项实体瘤I期临床研究。A223是靶向JAK1和JAK2激酶的选择性抑制剂,正在开展针对类风湿关节炎和斑秃的Ⅱ期临床;A277为选择性外周κ阿片受体激动剂,具有显著的抗瘙痒效果,正在开展治疗尿毒症瘙痒的Ⅱ期研究。结语不难预见,随着多款产品迈入商业价值兑现期,以及后续可能产生的合作收入,科伦博泰将迎来“里程碑+商业化”的稳健发展时期。参考资料:1.科伦博泰公告、财报、官微2.民生证券、国联证券研报声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智咨询立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请点击右侧在线咨询反馈。



 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划





