2021年1月12日,国家药监局组织制定了《药品上市后变更管理办法(试行)》,并于发布之日起实施,根据《药品上市后变更管理办法(试行)》及相关政策解读,总结出药品转让流程、时间、费用(境内药品转让)等信息。
2016年6月6日,《药品上市许可持有人制度试点方案》(以下简称《方案》)正式出台。 标志着我国药品注册制度将由上市许可与生产许可的“捆绑制”,向上市许可与生产许可分离的“上市许可持有人制度”转型。这一制度的出台不仅有利于药品的创新和研发,也优化了行业资源配置,同时提高了国家对于药品质量的监管效能。2019年12月1日,试点4年的MAH制度正式实施,这对于缺乏生产条件的研发机构与研发实力薄弱的生产企业都有利无害,不仅能将研发机构的研发成果转化成可用的医药产品,也可将因研发实力薄弱而失去产品竞争力的生产企业完成产品的升级、变革,在充满竞争力的市场中获得一席之地。
那么,企业如若想完成药品上市许可持有人的转让,应该怎么做呢?
2021年1月12日,国家药监局组织制定了《药品上市后变更管理办法(试行)》,并于发布之日起实施,根据《药品上市后变更管理办法(试行)》及相关政策解读,总结出药品转让流程、时间、费用(境内药品转让)等信息:
一、 流程及时间
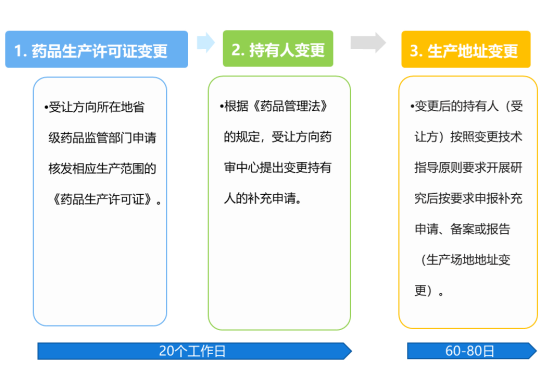
该流程为药品转让过程中发生药品生产场地变更时的流程,如若未发生生产场地的变更,则只需按照前两步完成转让流程。注意的是:完成上述申请后企业还需进行药品生产质量管理规范的符合性检查。生产场地包括持有人自有的生产场地或其委托生产企业相应的生产场地。生产场地变更是指生产地址的改变或新增,或同一生产地址内的生产场地的新建、改建、扩建。
二、费用
按照药品转让流程,其中涉及到向CDE提交补充申请,同时在《药品上市后变更管理办法(试行)》政策解读“五、药品转让过程中,仅持有人变更,生产场地、生产工艺等其他事项均未发生变更的,在持有人变更获得批准后是否需要药品生产质量管理规范的符合性查?”这一问题中提到只变更了持有人,药品生产场地、生产工艺等均未发生变更,变更后的持有人及药品生产企业均应满足药品生产质量管理规范的符合性检查要求,转让的药品在通过药品生产质量管理规范的符合性检查,符合产品放行要求后,方可上市销售。因此,转让过程费用为补充申请注册费中需技术审评类。根据国家药监局关于重新发布药品注册收费标准的公告(2020年第75号):其中包括了新药注册费、仿制药注册费的相关收费标准,而药品转让涉及到提交补充申请注册费(需技术审评类),收费标准为9.96万元(注:一个原料药或一个制剂为一个品种计)。

三、需准备的资料
根据国家药监局发布关于药品上市许可持有人变更申报资料要求,结合药品转让过程相关事项,总结出药品转让过程中可能需要准备的相关文件见下表:

四、总结
MAH制度下的药品转让,不仅盘活了研发实力薄弱企业闲置的生产线、更提高了我国医药制造业的产能利用率。同时,药品上市许可持有人有自主选择生产企业的权利,生产企业也可根据企业产品结构调整方案选择相应的产品生产。这种自由、自发的市场合作行为,不仅激发了药品研发、生产企业的创业激情,也有助于改善我国制药工业低水平现状,使我国的医药资源得到合理利用。
 产业与战略研究
产业与战略研究 品类与产品规划
品类与产品规划 研发与投资决策
研发与投资决策 卓越上市策划
卓越上市策划 成熟产品策划
成熟产品策划
想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们

想了解更多报告信息
请扫描二维码联系我们
